التفاعلات في المحاليل المائية

تفاعلات المحاليل المائية هي تفاعلات تحدث في وسط مائي أو بمعنى آخر في الماء أو في الأيونات التي تنتج عن انحلال المواد الأيونية في الماء.
تعد تفاعلات المحاليل المائية من أهم التفاعلات الكيميائية، إذْ أنها تشمل عدد كبير من التفاعلات الهامة في كل من مجال الكيمياء غير العضوية والكيمياء العضوية، وتعتمد دراسة هذه التفاعلات على ما يسمى نظرية المحاليل.
خصائص المحاليل المائية
تتميز المحاليل المائية بالعديد من الخصائص الهامة، ومنها:


- تتميز المحاليل المائية بأنها موصلة للكهرباء، وذلك لأن جزيئات الماء (H2O) من المواد القطبية التي تذيب المواد الأيونية.
- تتميز المحاليل المائية بحدوث تفاعلات حمض-قاعدة وتفاعلات أكسدة-اختزال، وذلك بسبب قدرة الماء على إنتاج أيونات الهيدرونيوم (H3O+) وأيونات الهيدروكسيد (OH–).
- تتميز المحاليل المائية بالعديد من الظواهر الفيزيائية والكيميائية، ومن أهمها ظاهرة الاستحلاب والتأين.

أنواع تفاعلات المحاليل المائية

تتعدد أنواع تفاعلات المحاليل المائية، ومن أهمها:

تفاعلات حمض-قاعدة

تفاعلات حمض-قاعدة هي تفاعلات تحدث بين الأحماض والقواعد، وينتج عنها أملاح وماء.

هناك العديد من أنواع تفاعلات حمض-قاعدة، ومن أهمها:
- التفاعل بين حمض قوي وقاعدة قوية، وينتج عنه ملح متوسط.
- التفاعل بين حمض ضعيف وقاعدة قوية، وينتج عنه ملح حمضي.
- التفاعل بين حمض قوي وقاعدة ضعيفة، وينتج عنه ملح قاعدي.
- التفاعل بين حمض ضعيف وقاعدة ضعيفة، وينتج عنه ملح ضعيف.

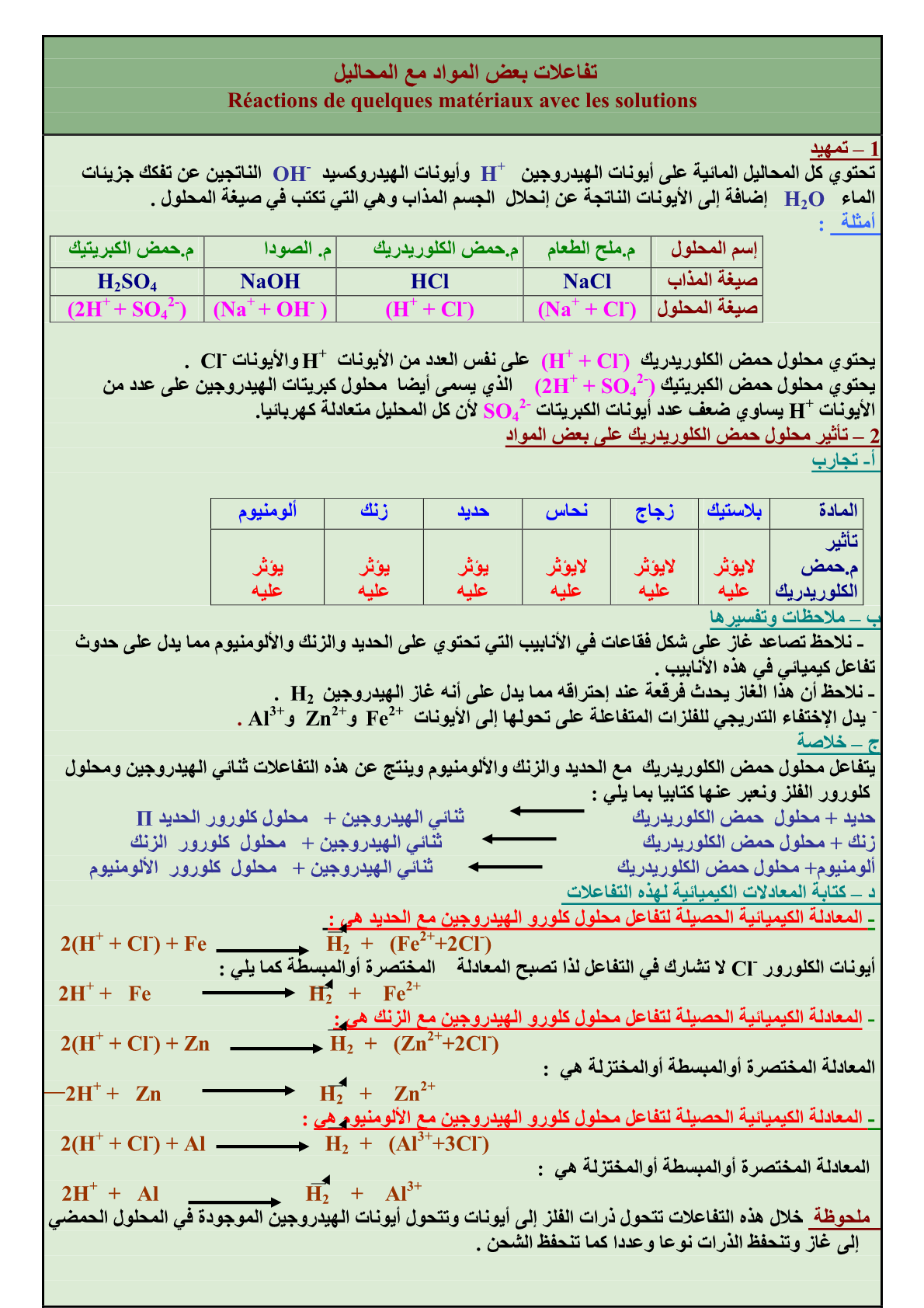
تفاعلات أكسدة-اختزال

تفاعلات أكسدة-اختزال هي تفاعلات تحدث بين مؤكسد ومختزل، وينتج عنها تبادل للإلكترونات.
بمعنى آخر، تحدث تفاعلات الأكسدة-الاختزال عندما يحدث انتقال للإلكترونات بين ذرتين أو أكثر، وتسمى الذرات التي تكتسب الإلكترونات بالمواد المختزلة، بينما تسمى الذرات التي تفقد الإلكترونات بالمواد المؤكسدة.

هناك العديد من أنواع تفاعلات أكسدة-اختزال، ومن أهمها:

- التفاعل بين مؤكسد قوي ومختزل قوي، وينتج عنه انتقال عدد كبير من الإلكترونات.
- التفاعل بين مؤكسد ضعيف ومختزل قوي، وينتج عنه انتقال عدد قليل من الإلكترونات.
- التفاعل بين مؤكسد قوي ومختزل ضعيف، وينتج عنه انتقال عدد كبير من الإلكترونات.
- التفاعل بين مؤكسد ضعيف ومختزل ضعيف، وينتج عنه انتقال عدد قليل من الإلكترونات.

تفاعلات الترسيب
تفاعلات الترسيب هي تفاعلات تحدث بين محلولين، وينتج عنها تكون مادة صلبة غير قابلة للذوبان في الماء.

تتميز تفاعلات الترسيب بأنها سريعة الحدوث وسهلة الملاحظة، ويمكن استخدامها في الفصل بين الأيونات المختلفة في محلول.
مثال على تفاعل الترسيب هو تفاعل محلول نترات الرصاص (PbNO3) مع محلول كلوريد الصوديوم (NaCl)، وينتج عنه تكون راسب أبيض اللون من كلوريد الرصاص (PbCl2).

تفاعلات المعقدة
تفاعلات المعقدة هي تفاعلات تحدث بين أيون معدني ومركب عضوي، وينتج عنها تكون معقد تناسقي.

تتميز معقدات التناسق بأنها مواد مستقرة، ولها العديد من التطبيقات في الصناعات المختلفة، مثل صناعة الأدوية والمواد الملونة.

مثال على تفاعل المعقدة هو تفاعل أيون النحاس الثنائي (Cu2+) مع الأمونيا (NH3)، وينتج عنه تكون معقد تناسقي أزرق اللون له الصيغة [Cu(NH3)4]2+.
تفاعلات الاستبدال

تفاعلات الاستبدال هي تفاعلات تحدث بين مركب عضوي وحال، وينتج عنها استبدال ذرة أو مجموعة ذرات في المركب العضوي بذرة أو مجموعة ذرات في الحال.
هناك العديد من أنواع تفاعلات الاستبدال، ومن أهمها:
- تفاعلات الاستبدال النكليوفيلي، وتحدث بين مركب عضوي وحال نكليوفيلي.
- تفاعلات الاستبدال الإلكتروفيلي، وتحدث بين مركب عضوي وحال إلكتروفيلي.
- تفاعلات الاستبدال الجذري، وتحدث بين مركب عضوي وحال جذري.
تفاعلات الحلمهة
تفاعلات الحلمهة هي تفاعلات تحدث بين مركب عضوي يحتوي على مجموعة استر وحال، وينتج عنها تكوين كحول وحمض.
تتميز تفاعلات الحلمهة بأنها بطيئة الحدوث، ويمكن تسريعها باستخدام حفاز.
مثال على تفاعل الحلمهة هو تفاعل إستر الأسيتات (CH3COOCH3) مع الماء، وينتج عنه تكون كحول الميثانول (CH3OH) وحمض الأسيتيك (CH3COOH).

تفاعلات الألكلة

تفاعلات الألكلة هي تفاعلات تحدث بين مركب عضوي يحتوي على مجموعة ألكيل وحال، وينتج عنها تكوين مركب عضوي جديد يحتوي على مجموعة ألكيل.
هناك العديد من أنواع تفاعلات الألكلة، ومن أهمها:

- تفاعلات الألكلة النكليوفيلي، وتحدث بين مركب عضوي يحتوي على مجموعة ألكيل وحال نكليوفيلي.
- تفاعلات الألكلة الإلكتروفيلي، وتحدث بين مركب عضوي يحتوي على مجموعة ألكيل وحال إلكتروفيلي.
- تفاعلات الألكلة الجذري، وتحدث بين مركب عضوي يحتوي على مجموعة ألكيل وحال جذري.
أهمية تفاعلات المحاليل المائية
تفاعلات المحاليل المائية لها أهمية كبيرة في العديد من المجالات، ومن أهمها:
- الكيمياء الحيوية: تدخل تفاعلات المحاليل المائية في العديد من العمليات الحيوية الهامة، مثل هضم الطعام وتخزين الطاقة وإنتاج الهرمونات.
- الكيمياء الصيدلانية: تستخدم تفاعلات المحاليل المائية في تصنيع الأدوية وإنتاج المضادات الحيوية.
- الكيمياء البيئية: تستخدم تفاعلات المحاليل المائية في معالجة المياه ومعالجة النفايات.

خاتمة
تفاعلات المحاليل المائية هي تفاعلات هامة لها العديد من التطبيقات في مختلف المجالات، وتعتمد دراسة هذه التفاعلات على ما يسمى نظرية المحاليل.

تتعدد أنواع تفاعلات المحاليل المائية، ومن أهمها تفاعلات حمض-قاعدة وتفاع